เราคือผู้เชี่ยวชาญในด้านการป้องกันสนิมที่มีประสบการณ์มากกว่า 30 ปี
เหล็กเป็นวัสดุหนึ่งที่เป็นที่นิยมใช้ในการสรรสร้างสิ่งประดิษฐ์ต่างๆ เนื่องจากมีความแข็งแรงทนทานและมีราคาถูก หากแต่ปัญหามักจะตามมาหลังจากใช้เหล็กในระยะเวลานานก็คือการเกิดสนิม ซึ่งนอกจากจะมีผลกระทบต่อความมั่นคงและความแข็งแรงโดยตรงแล้ว ยังลดทอนความสวยงามของชิ้นงานลงอีกด้วย
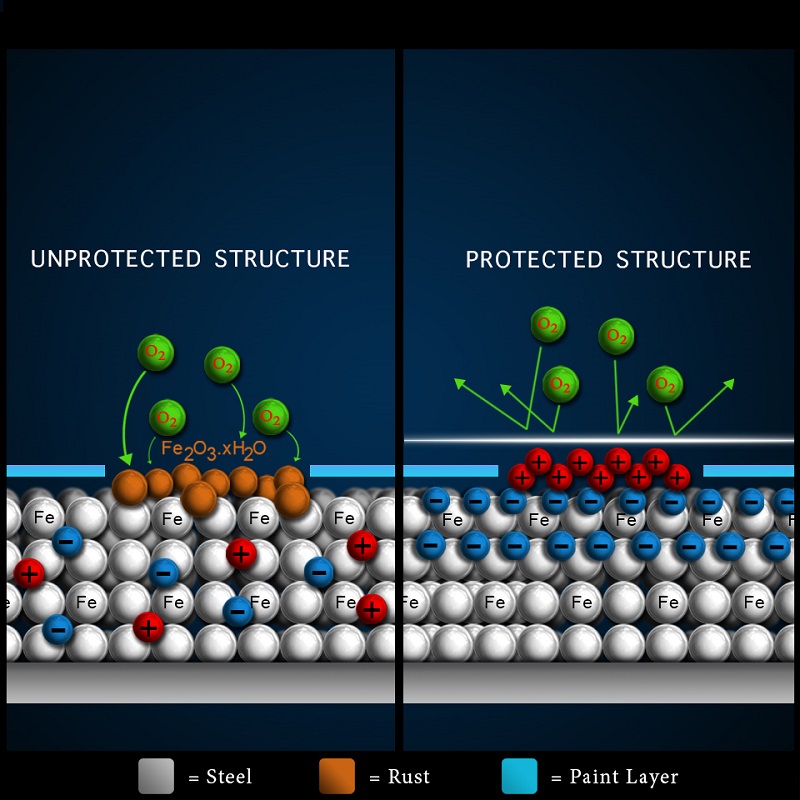
วิธีการป้องกันสนิมที่ใช้กันอยู่ในปัจจุบันมักจะเป็นการเคลือบผิวเหล็กด้วยสีกันสนิมหรือวัสดุกันสนิมชนิดต่างๆ ซึ่งจะช่วยลดปัญหาการเกิดสนิมได้เพียงระยะเวลาหนึ่งเท่านั้น แต่เมื่อมีการหลุดร่อนหรือแตกร้าวของสีหรือวัสดุที่ใช้กันสนิมจนหมดประสิทธิภาพ ก็จะทำให้ทรัพย์สินของเราเกิดสนิมอีกครั้งหนึ่ง ทำให้ต้องเสียเวลา ค่าใช้จ่าย ในการบำรุงรักษาและทาเคลือบใหม่เป็นระยะๆ แต่ i-guard ของเราจะใช้วิธีการนำประจุไฟฟ้าเข้าไปเรียงเพื่อป้องกันสนิม
แท้ที่จริงแล้ว การเกิดสนิมสามารถอธิบายได้ด้วยสมการไฟฟ้าเคมี โดยแบ่งปฏิกิริยาที่เกิดขึ้นในแต่ละ ขั้วไฟฟ้าดังนี้ ขั้ว แอโนด (anode) เมื่อน้ำหรือความชื้นสัมผัสกับเหล็ก เหล็กจะเกิดการจ่ายอิเล็กตรอนดังสมการ
Fe(s) → Fe2+(aq) + 2e- หรือ Fe(s) → Fe3+(aq) + 3e- ปฏิกิริยาเคมีไฟฟ้าในขั้วแอโนดนี้ เหล็กจะเกิดการปฏิกิริยาออกซิเดชัน (Oxidation) จ่ายอิเล็กตรอนออกไป ทำให้เหล็กในสถานะที่เป็นของแข็งเปลี่ยนสภาพผุพังไปเป็นไอออนหรือเป็นสารประกอบออกไซด์
ขั้ว แคโทด (cathode) เกิดการรับอิเล็กตรอนของน้ำและอากาศจนเกิดเป็นไฮดรอกไซด์ไอออนขึ้นดังสมการ
O2 (g) + 2H2O(l) + 4e- → 4OH-(aq)
ปฏิกิริยาเคมีไฟฟ้าในขั้วแอโนดนี้ เป็นการเกิดปฏิกิริยารีดักชัน (Reduction) โดยน้ำและออกซิเจนในอากาศ รับอิเล็กตรอน ให้ผลิตภัณฑ์เป็นไฮดรอกไซด์ไอออน
หลังจากนั้นผลิตภัณฑ์จากทั้งสองขั้ว คือ แอโนดและแคโทด ได้แก่ ไฮดรอกไซด์และเหล็กในสภาพไอออน จะรวมกันเกิดเป็นสนิมเหล็ก ดังสมการ
Fe2+(aq) + 2OH-(aq) → Fe(OH)2(s) 4Fe(OH)2(s) + O2(g) +2H2O → 4Fe(OH)3(s)
สนิมเป็นเรื่องของปฏิกิริยาไฟฟ้าเคมีพื้นฐานที่เราสามารถสังเกตได้ พบได้ในชีวิตประจำวัน